
氮,原子序数7,原子量为14.006747。元素名来源于希腊文,原意是"硝石"。1772年由瑞典药剂师舍勒和英国化学家卢瑟福同时发现,后由法国科学家拉瓦锡确定是一种元素。氮在地壳中的含量为0.0046%,自然界绝大部分的氮是以单质分子氮气的形式存在于大气中,氮气占空气体积的78%。氮的最重要的矿物是硝酸盐。氮有两种天然同位素:氮14和氮15,其中氮14的丰度为99.625%。
氮为无色、无味的气体,熔点-209.86°C,沸点-195.8°C,气体密度1.25046克/升,临界温度-146.95°C,临界压力33.54大气压。
氮分子是由两个氮原子组成,特别稳定,它对许多反应试剂是惰性的。在高温、高压并有催化剂存在的情况下,氮和氢作用生成氨。空气中的单质氮和氧在雷电的作用下,可生成氧化氮。锂和氮在常温下即可反应,过渡金属在高温下也可和氮反应,生成氮化物。
氮是组成动植物体内蛋白质的重要成分,但高等动物及大多数植物不能直接吸收氮。氮主要用来制造氨,其次是制备氮化物、氰化物、硝酸及其盐类等。此外,还可用作保护性气体、泡沫塑料中的发泡剂,液氮可用于冷凝剂。
|
元素 名称 |
|
||||||||||||||
|
原 子 结 构 |
|
电子模型 | 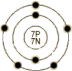 |
||||||||||||
|
发 现 |
1772年在苏格兰爱丁堡,由 D. Rutherford 发现。 | ||||||||||||||
|
来 源 |
空气中含有大量的氮气,工业上制氮气是采用液化空气,然后分馏而得。 | ||||||||||||||
|
用 途 |
氮作为气体,具有很多工业用途,液氮具有非常低的温度,所以,用于低温储藏精子,卵子等,作为惰性气体,用食品及化学物质的储藏,以防止其氧化。 | ||||||||||||||
|
物 理 性 质 |
|
||||||||||||||
|
化 学 性 质 |
|||||||||||||||
|
地 质 数 据 |
|
||||||||||||||
|
生 物 数 据 |
|
||||||||||||||